トップ>研究内容>研究成果(long version)>1. 上皮平面内極性の形成機構
1. 上皮平面内極性の形成機構
研究の背景と成果
平面内極性の形成において、7回膜貫通型カドヘリン Flamingo (Fmi) の時空間的な局在様式が重要であることを我々は以前から提唱していた。 ショウジョウバエの翅表皮をモデル系(図1)とした研究から、Fmiは翅毛形成 に先行して遠近軸方向の境界(PD境界)に一過的に局在すること、また頂端部?基底部軸に沿って観察すると、頂端部に近いアドヘレンスジャンクションに分 布していること明らかにした (図1)。 我々が Fmi に関する最初の論文を発表した後、 Frizzled (Fz) をはじめとして 多くの極性制御タンパク質について、 Fmi の細胞内分布と共通する局在様式が他のグループから報告された (Uemura and Shimada, 2003)。我々自身も、 Dishevelled (Dsh) の細胞内分布を明らかにした (Shimada et al. 2001)。 しかしながら、 Fz や Fmi などが、どのような仕組みで PD境界に局在するのか全く不明であった。例えば Fz は PD境界に向かって選択的に輸送されるのか(極性輸送モデル)、あるいは輸送に方向性はなく PD境界に達した Fz のみが細胞膜に安定に存在するのか。それとも、どの境界であれいったん 細胞膜に挿入された後、 PD境界に向かって膜上を移動していくのだろうか。我々は生体内経時観察や電子顕微鏡を用いた解析などを総合して、この問題に取り組んだ。
関連論文
- Yuko Shimada, Tadao Usui, Shinichi Yanagawa, Masatoshi Takeichi, and Tadashi Uemura. Asymmetric colocalization of Flamingo, a seven-pass transmembrane cadherin, and Dishevelled in planar cell polarization. Current Biology, 11: 859-63 (2001).
- Tadashi Uemura and Yuko Shimada. Breaking cellular symmetry along planar axes in Drosophila and vertebrates. Journal of Biochemistry (Tokyo), 134:625-30 (2003).
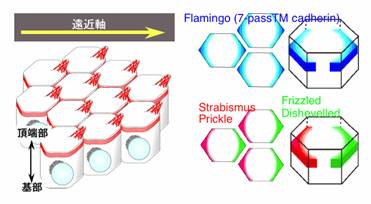
図1 ショウジョウバエ翅の表皮細胞の模式図(左)と、平面内極性を調節する分子群の細胞内局在(右)
翅の表皮細胞は、遠位側の細胞端でアクチン線維を集合させて翅毛をつくる。
主要な発表論文
- Yuko Shimada(島田裕子), Shigenobu Yonemura, Hiroyuki Okura, David Strutt, and Tadashi Uemura. Polarized transport of Frizzled along the planar microtubule arrays in Drosophila wing epithelium. Developmental Cell, 10: 209-22 (2006).
我々はまず、 Fz::GFPを発現するトランスジェニック系統を用いた、生体内経時観察の系を立ち上げた。観察の結果、細胞質に存在する粒子状の Fz::GFPシグナルが、 翅毛 形成に先行して遠位側細胞境界に向かって動く傾向を発見した。二重染色や免疫電子顕微鏡法を用いた解析から、このシグナルは Fz::GFP と Fmi を含む小胞(以下 Fz-Fmi小胞と記す)であることが示され、 D E-cadherin は含まれないことがわかった( D E-cadherin はショウジョウバエの上皮型カドヘリンで、PD境界に限らずどの境界にも存在するアドヘレンスジャンクションに分布する)。翅の微細構造を解析したとこ ろ、アドヘレンスジャンクションを含む平面に多数の微小管が存在し、しかも遠近軸に沿って配向していた(図2)。また Fz-Fmi小胞は、これらの微小管に結合あるいは近接して分布していた。微小管を標的とする薬剤で処理したところ、Fz::GFP や Fmi が PD境界に分布しなくなり、より発生後期においては、細胞の遠位側の先端ではなくほぼ中央から 翅毛 が生えた。この表現型は、 fz や fmi 変異体の表現型と酷似していた。以上の結果は、Fz-Fmi小胞が微小管に沿って細胞境界に輸送される極性輸送モデルを支持している(図3)。以上は、主 に、理化学研究所発生・再生科学総合研究センター、 細胞形態形成研究チーム(チームリーダー:米村重信博士) との共同研究である。
では、なぜ Fz-Fmi小胞は近位側ではなく、遠位側の細胞境界に輸送されるのだろうか。我々は個々の微小管のプラス端が、近位側と遠位側のどちらを向いているのか 検討する目的で、微小管の伸長端(プラス端)を可視化した。その結果、プラス端が遠位側を向いている微小管の方が、近位側を向く微小管よりも多いことが統 計的な解析により支持された。
世界的に見てほとんどの研究が固定した試料での解析にとどまっている。その中で本研究は、生体内経時観察や微細構 造解析などの細胞生物学的アプローチと遺伝学的アプローチを総合して、極性制御タンパク質を局在させる仕組みを解明しようとした。 (2)に述べるように、本研究は平面内極性の研究に新たな切り口を与え、我々自身がその先駆的な研究を発展させている。
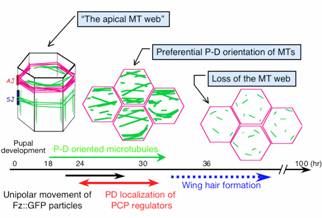
図2 ショウジョウバエ翅の表皮細胞における微小管のダイナミクス
横軸は蛹の発生の時間軸を示す。微小管を緑色の線で、 cortical actin をマゼンダで表している。AJ: adhetens junction; SJ: septate junction; P-D: proximal-distal.
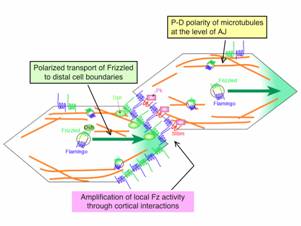
図3 Fz-Fmi小胞の極性輸送
Fz や Fmi などを含む小胞が、微小管(オレンジの線)に沿って遠位側の細胞境界に輸送される模式図。Fmi はホモフィリックな分子間結合能を持つので、遠位側の細胞境界に到着すると、対面(隣接する細胞の近位側の境界)にも Fmi が集積する。
今後の展開
個々の細胞が、 自分が置かれた平面内での位置情報をどのようにして読み取るのか?この基本問題を解明するために、 次に明らかにすべき3つの課題が示された。1)翅の遠近軸に沿って微小管を配向させる仕組みは何か。2)遠近軸に沿った微小管極性のわずかな偏りが、 Fz-Fmi小胞の極性輸送を支えているのか。もしそうならそのわずかな偏りを生じさせる機構は何か。そして 3)Fz-Fmi小胞の極性輸送を担うモーターの実体は何か。
現在、 Fz や Fmi よりも上位で働くと考えられている、非典型的カドヘリン群( Fat と Dachsous )を介する細胞間コミュニケーションが、 微小管の配向や極性を調節する可能性を検討している(Harumoto et al. 2010 で発表)。また、数理的な解析方法を導入し、微小管極性の非対称性がわずかであっても、 Fz は遠位側細胞境界に選択的に輸送されることを支持する結果を得ている。さらに、この数理的な解析結果から、輸送を担うモータータンパク質の processivity (微小管に結合してから解離するまでに進む平均進行距離)が低いほど、あるいは Fz-Fmi小胞に結合しているプラス端あるいはマイナス端に向かうモータータンパク質群の作用が拮抗しているほど、Fz は遠位側細胞境界に運ばれる可能性が高まることが 予測された(未発表データ) 。この予測と、遺伝学的手法などによるモータータンパク質の探索を総合して研究を進めている。
本研究を発展させて上記の問いを解くことができれば、平面内極性の欠陥が原因で生じる障害を、分子レベルで解明で きる可能性がある。ヒトを含む脊椎動物の気管支や輸卵管の上皮では、個々の上皮細胞が運動性をもった繊毛を保持している。この線毛が協調的に一方向性に往 復運動をすることで、気管支では内腔に入り込んだ異物を咽頭側へのみ移動させ排出するし、輸卵管では卵子を輸送する駆動力を提供している。また身体の左右 非対称性の形成においても、平面内極性の獲得を欠かすことができない。左右非対称性の形成には、ノードに生えている繊毛 (nodal cilia) が生む流れ (nodal flow) が重要な役割を果たす。最近、この繊毛は細胞の頂端部面において身体の後部側に偏った位置から生えていることが報告され、ノード細胞が獲得するこの平面内 極性が、nodal flow を生むのに重要な役割を果たすことが提唱された。以上の平面内極性に欠陥が生じれば、気管支炎、不妊、そして左右非対称性の異常につながることが予想され る。極性制御の中核的な分子作動機構は、種や器官の違いを超えて保存されていると期待しており、我々自身の極性輸送モデルを出発点としてその解明を目指 す。
