トップ>研究内容>研究成果(long version)>2. 7回膜貫通型カドヘリンファミリーの神経突起形成における役割
2. 7回膜貫通型カドヘリンファミリーの神経突起形成における役割
研究の背景と成果
我々は Flamingo(Fmi)の平面内極性における役割を報告する一方で、Fmi が軸索の投射パターンと樹状突起の伸長を調節することを明らかにした ( Senti et al. 2003; Reuter et al. 2003 )。 1 . で述べたように 平面内極性においては、 Fmi は Fz シグナル伝達経路の一員として働く。一方、 軸索および樹状突起における機能は、意外なことに Fz シグナル伝達経路とは異なる経路に属すること が示唆されたが ( Senti et al. 2003 ) 、 ほとんどの研究は変異体の表現型の記述に留まっており、 分子レベルでは解析されていなかった。この問題に取り組むために、ショウジョウバエを用いた遺伝学的アプローチに加えて、 Fmi のほ乳類ホモログの神経細胞における機能解析系も併用して研究した。
関連論文
- Kirsten-Andre Senti, Tadao Usui, Urs Greber, Tadashi Uemura#, and Barry J. Dickson#. Flamingo regulates R8 axon-axon and axon-target interactions in the Drosophila visual system. Current Biology, 13:828-832 (2003). #: corresponding authors.
- John E. Reuter, Timothy M. Nardine, Andrea Penton, Pierre Billuart, Ethan K. Scott, Tadao Usui, Tadashi Uemura, and Liqun Luo. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development, 130: 1203-1213 (2003).
主要な論文1
- Yasuyuki Shima(島康之), Mineko Kengaku, Tomoo Hirano, Masatoshi Takeichi, and Tadashi Uemura. Control of dendritic maintenance and growth by a mammalian 7-pass transmembrane cadherin, Celsr2. Developmental Cell, 7:205-216 (2004).
7回膜貫通型カドヘリンは進化的に高度に保存されており、ヒトを含めたほ乳類のゲノムには Celsr1-Celsr3 ( Celsr: c adherin, E GF-like, L AG-like, and s even-pass r eceptor ) の3つの遺伝子が存在する。我々はマウスにおいて Celsr1-Celsr3 のそれぞれが、神経発生において特徴的な発現パターンを示すこと、そしてCelsr2タンパク質が神経突起に分布することを明らかにした (Shima et al. 2002)。
Celsr2 の樹状突起パターン形成における役割を解析するために、 Celsr2 の発現を RNA干渉を利用して ノックダウンさせた。効果的な干渉RNA (siRNA: small interfering RNA) を発現するプラスミドを、EGFP発現プラスミドとともに、遺伝子銃を用いてラット脳のスライスに導入した。siRNAの発現により、プルキンエ細胞や錐 体細胞では樹状突起の形態が顕著に単純化した。この表現型は、少なくともプルキンエ細胞に関しては突起の縮退が原因であることが強く示唆された。また、 siRNA発現プラスミドとともに、siRNAに非感受的な Celsr2 cDNAの発現プラスミドを共導入することによって、表現型を復帰させることができた。 従って siRNA発現プラスミドによる効果は Celsr2 の機能喪失によるものであることが示された。 ノックダウン表現型を復帰させるアッセイを利用して、Celsr2のドメインと機能の関係を検討したところ、Celsr2-Celsr2 間のホモフィリックな結合を担うカドヘリンリピートが、レスキュー能に欠かせないことがわかった。この結果は、 樹状突起?樹状突起あるいは樹状突起?軸索間における Celsr2を介する相互作用が、樹状突起の維持または成長に必須であることを示す(図4)。以上は、京都大学大学院理学研究科平野丈夫教授らとの共同研 究である。
本研究において、ほ乳類の7回膜貫通型カドヘリンの分子機能をはじめて解析したのみならず、 RNAi を利用した研究例の中で、最も厳密な基準を適用した。即ち、ノックダウン表現型が siRNA の発現による非特異的な副作用の結果ではなく、 Celsr2 の機能喪失であることを証明した。この報告で用いた RNAi による遺伝子発現ノックダウン法は、個体レベルでの遺伝子ノックアウト法よりも簡便に行うことができ、かつ発生のより後期での細胞自律的な遺伝子機能を単 一細胞のレベルで明らかにできる。従って、個体レベルでの遺伝子ノックアウト法と相補的なアプローチとして、様々な遺伝子の機能解析に利用可能である。本 研究において作製した ノックダウン プラスミドを、 電気穿孔法により子宮内胎仔大脳皮質で移動中の神経細胞に導入したところ、移動終了後の神経細胞の 樹状突起形態が単純化する傾向が観察された(慶応義塾大学仲嶋研究室田畑助手との共同研究)。従って生体内でのノックダウン表現型が、脳スライスを用いて 得られた結果と一致することが示された 。
関連論文
- Yasuyuki Shima, Neal G. Copeland, Debra J. Gilbert, Nancy A. Jenkins, Osamu Chisaka, Masatoshi Takeichi, and Tadashi Uemura. Differential Expression of the Seven-pass Transmembrane Cadherin Genes Celsr1- 3 and Distribution of the Celsr2 Protein during Mouse Development. Developmental Dynamics, 223: 321-332 (2002).
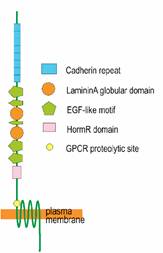
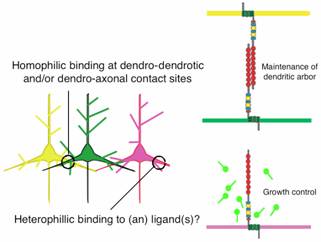
図4 7回膜貫通型カドヘリンのドメイン構造(左)と神経突起の伸長調節における役割のモデル図(右)
神経突起同士が接する面において、7回膜貫通型カドヘリン間のホモフィリックな結合は、突起の維持または成長に重要な役割を果たす(右上段)。一方、リガンド とのヘテロフィリックな結合によっても突起の伸長は調節される(右下段)。
主要な論文2
-
Yasuyuki Shima, Keisuke Sehara, Manabu Nakayama, Shinya Kawaguchi,
Hoshino Mikio, Yoichi Nabeshima, Tomoo Hirano, and Tadashi Uemura
Opposing roles in neurite growth control by two 7-pass transmembrane
cadherins. Nature Neuroscience, 10; 963-969 (2007)
3つのほ乳類7回膜貫通型カドヘリン遺伝子 ( Celsr1 - Celsr3 ) のうち、 Celsr2 と Celsr3 は胚期および生後間もない神経細胞で発現している。Celsr2 と Celsr3 の機能を、上述したRNAi法による発現抑制、そして Celsr2 あるいは Celsr3 を発現する細胞株との共培養の系において検討した。その結果、いずれの系においても Celsr2は突起成長を促進するのに対して、Celsr3は抑制する事が示された。改変分子を用いた解析により、両者の機能の差は、7回膜貫通型領域内 の特定のアミノ酸残基の違いに依存している事が示唆された。それぞれの細胞外カドヘリンリピート領域を組換えタンパク質として調製し、分散培養神経細胞の 培地に添加し、細胞内カルシウム濃度の変化や突起伸長に与える効果を調べた。以上の結果を総合して、Celsr2 と Celsr3 はGタンパク共役型受容体として活性に差があり、その差によって突起成長を異なる様式で制御する仮説を提案している。生体内において神経突起が成長しつつ 互いにコンタクトする際に、Celsr2 と Celsr3 はそれぞれのホモフィリックな結合により活性化され、カルシウムシグナリングを介して、突起成長を伸長あるいは抑制するのではないか。
主要な論文3
- Hiroshi Kimura(木村宏史), Tadao Usui, Asako Tsubouchi, and Tadashi Uemura. Potential dual molecular interactions of the Drosophila 7-pass transmembrane cadherin Flamingo in dendritic morphogenesis . Journal of Cell Science, 119: 1118-29 (2006).
ショウジョウバエの dendritic arborization (da) neuron を解析系として用い、樹状突起の形態形成に重要な役割を担う Fmi の機能ドメインを探索した。 da neuron の 樹状突起 は、 胚期から幼虫期にかけて、 表皮細胞の基底部側表面 を 二次元的に展開させる(図5)。 fmi 変異胚においては、その樹状突起は背側へ過剰に伸長してしまう。この過剰伸長の表現型は、 Fmi 全長分子を神経細胞でのみ発現させることで回復した。興味深いことに、ホモフィリックな分子間結合に必要なカドヘリンリピートを欠失した分子を、神経細胞 で発現させた場合でも表現型は部分的に回復した。これらの解析やほ乳類 Fmi ホモログのドメイン解析に基づくデータ (Shima et al., 2004) を総合すると、突起の伸長制御において、Fmi はホモフィリックに結合する接着分子として機能するだけではなく、未同定のリガンドのレセプターとして機能している局面があることが強く示唆された(図 4)。
この仮想上のリガンドを同定するために、7回膜貫通型カドヘリンの細胞外領域の一部からなる「レセプタープローブ」を作製し、それを用いた発現スクリーニ ングを行った。現在までに複数の分泌性タンパク質をリガンドの候補として分離し、それぞれの突起伸長に与える影響を調べている。 また、構造 -機能解析の結果を踏まえ、Fmi の下流のシグナル伝達経路を明らかにする目的で、カルボキシル末端側の細胞質領域と結合する分子を探索した。候補分子について機能解析を進めている。

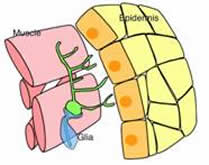
図5 da neuronでGFPを発現するトランスジェニックフライ(左)と、da neuronの空間配置の模式図(右)
第3齢幼虫のホールマウント写真と単一細胞の拡大写真の例(左側の枠内)。 da neuron (右側の緑色の細胞)は表皮細胞と筋肉に挟まれた空間に存在し、その 樹状突起を 二次元的に展開させる。軸索はグリア細胞に包まれている。
今後の展開
機能的な神経回路の形成には、神経突起(軸索と樹状突起)の伸長/縮退のダイナミクスが適切に調節されることが必 要である。突起が稠密な中枢神経系では、神経細胞同士の相互作用が神経突起成長の調節に大きな役割を果たしていると考えられる。本研究では7回膜貫通型カ ドヘリンファミリーに注目し、従来は 変異体の表現型を記述するレベルにとどまっていた研究から、分子レベルでの解析に踏み込んだ。
本研究では神経細胞の初代培養系を用いて、 7回膜貫通型カドヘリンが Gタンパク質と共役することを支持するデータを得た。Fmi/Celsr を介するシグナリングが、細胞骨格系をどのように調節するかを解析するには、それらの分子を細胞膜上に発現する細胞株があればアッセイが容易になり、さら に研究が進展すると期待できる。Gタンパク質と共役するレセプターの一部については、細胞膜への分布を促進させるアクセサリータンパク質が報告されてい る。従ってこれらのアクセサリータンパク質との共発現により、細胞表面に分布する7回膜貫通型カドヘリンの分子数を増やせないかを検討している。また、細 胞膜貫通ドメインを含む Fmi断片と相互作用する分子の探索を開始しており、その中に目的にかなうアクセサリータンパク質がないかを調べる予定である。以上のように、細胞外、細 胞膜内、そして細胞内のそれぞれの空間で Fmi/Celsr と相互作用する分子の解析を進めれば、7回膜貫通型カドヘリンが支える神経回路形成の分子機構をさらに深めることができるであろう。
