研究内容まとめ2
研究成果 (long version)
1.研究開始当初の背景
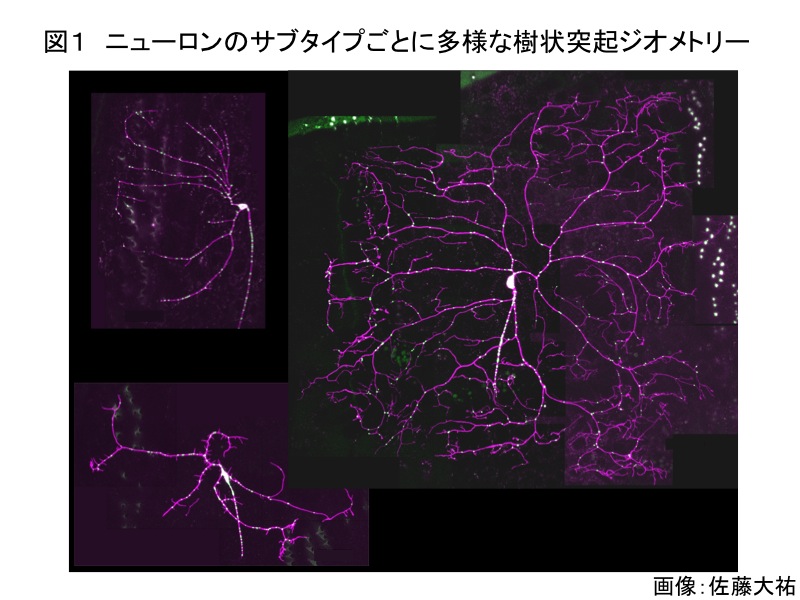
軸索ガイダンスの研究の進展に比べて、樹状突起のパターン形成に関しては多くの問題が明らかにされていない。軸索はニューロンのクラス間で形態上の差異が小さいため、多数の軸索を集団として扱う実験系を用いて研究が発展してきた。しかし、クラス毎に形状が大きく異なり、狭い空間内で複雑に分岐する樹状突起のパターン形成を研究するには、一細胞の解像度で突起を可視化する必要がある。そこで我々は、ショウジョウバエのdendritic arborization (da) neuronを主な解析系とし、その樹状突起を一細胞レベルで観察できる系を作り上げた。
2.研究の目的
樹状突起はシナプス入力または感覚入力を受け取る神経突起である。軸索に比べ、樹状突起のパターンはニューロンのクラス毎に著しく異なり、この多様性は各クラスに特有の生理機能を反映していると考えられている。本研究では、樹状突起の分岐の複雑度、伸長、そして安定性がどのように調節されるのかに注目する。そしてクラス毎に特徴的なパターンを形成させる仕組みを追究しつつ、その仕組みと、複数のクラスに共通に用いられる機構との接点を探り、樹状突起形成を調節する遺伝子プログラムを解明することを目指す。
3.研究の方法
ショウジョウバエのdendritic arborization (da) neuronを主な解析系とし、その樹状突起を一細胞レベルで観察できる系を作り上げた(図1)。特定のクラスの da neuron で発現する遺伝子を分離したので、その中から、各クラスに特徴的な突起のパターン形成に関わる遺伝子を発見した。このアプローチと並行して、突起の分岐や伸長の異常を指標とする遺伝学的なスクリーニングを行い、原因遺伝子を同定しそれぞれの機能を調べた。そして、ショウジョウバエを用いた解析で得られた結果が、哺乳類のニューロンにも適用できるかどうかを検証した。さらに、実験から発見した現象をベースにした数理モデルを構築し、突起形成を担うシステム全体の特性を明らかにすることを目指した。
4.研究成果
(1) 樹状突起パターンの多様性を支える転写調節プログラムの解明
幼虫期において、da neuron は樹状突起の分岐がより複雑な順番に、そして受容野のサイズがより大きな順番に、クラスIからクラスIV までに分類されている。我々は本研究の開始時点で、BTB domain-Zinc fingerタンパク質である Abrupt (Ab) が、クラスIニューロンに特徴的なくし状の単純な突起形成に果たす役割を明らかにしていた (Sugimura et al., Neuron, 2004)。本研究ではクラスIVニューロンで選択的に発現する、Early B-Cell Factor (EBF)ファミリーに属するKnot (Kn) に着目した。機能喪失表現型の解析、そして異所発現実験の両方の結果から、Kn がクラスIVニュー ロンにおいて細胞自律的に機能し、特徴的な高度に分岐した突起形成を賦与することを明らかにした (Hattori et al., 2007)。さらに、Ab と Kn が調節する転写調節プログラムを、全ゲノムにわたる(ゲノムワイドな)手法により解析してその全貌を明らかにしました (Hattori et al., 2013)。
(2) 突起形成を調節する細胞間相互作用の分子的実体
da neuronとグリア細胞、およびda neuronと表皮細胞との相互作用が、樹状突起の正常なパターン形成と軸索分岐の抑制に必要であり、かつグリア細胞の突起伸長も調節することを明らかにした。これらの細胞間相互作用において、免疫グロブリンスーパーファミリーの中の、L1ファミリーに属するNeuroglian (Nrg)と、Nrgを細胞骨格にアンカーさせるAnkyrin (Ank)が、多面的な役割を果たす (Yamamoto et al., 2006)。
一つのニューロンから伸長する樹状突起は、互いに避け合い絡まることはない。同一ニューロンの樹状突起はこのような “self-avoidance” を示す一方で、異なるクラスに属するニューロンの突起どうしは避け合うことなく、同じ受容野に共存する。この self-avoidance に、Down's syndrome Cell Adhesion Molecule (Dscam) を介する突起間の反発作用が必要であることを示した。Dscam 遺伝子からは、3万個以上の isoform が作られると予想されている。異なるクラスに属するニューロンが受容野を共有できるのは、クラス毎に異なる Dscam isoform が発現しているためであるらしい (Hughes et al., 2007)。
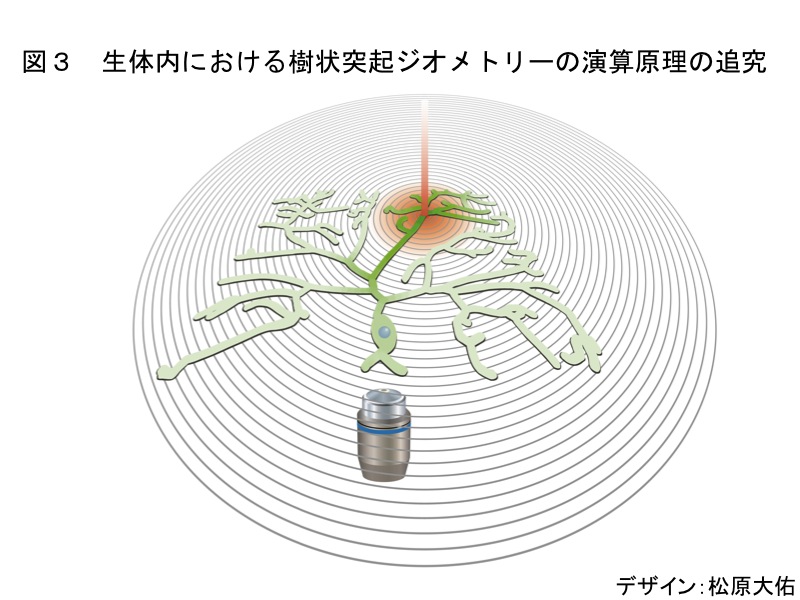
最も複雑な分岐パターンを持つクラスIVニューロンは、同一細胞に由来する樹状突起同士が反発して避け合うこと(姉妹樹状突起の交差忌避)で空間充填的 (space-filling) なパターンを獲得する。本研究室で発見された7回膜貫通型カドヘリンFlamingo (Fmi) の機能減弱型変異体では、この樹状突起の相互忌避に異常があることを発見した。Fmi の下流の分子経路を解明する目的で結合分子を探索したところ、LIM-PETドメインタンパク質Espinas (Esn) を単離した。esnノックアウト系統のクラスIVニューロンの樹状突起においては、fmi変異体と同様に、姉妹樹状突起の交差忌避異常が生じていた。そして、esnノックアウト個体のクラスIVニューロン特異的に esn を発現させたところ、交差頻度を野生型と同程度まで回復させることができた。さらにEsnのドメイン解析から、FmiとEsnの分子間結合が、突起間の忌避に必要であることが示された。以上の結果より、Esn が Fmi に結合し樹状突起の自己忌避の調節を行っていることを明らかにした (Matsubara et al., 2011)。今後は、交差忌避のような樹状突起ジオメトリーが、クラスIVニューロンに固有の発火様式やシナプス伝達効率などの神経生理機能に、どのように寄与するかを解明することにも挑戦する(図3)。
(3) 樹状突起形成と維持を支えるオルガネラおよび細胞骨格のダイナミクス
突然変異体のスクリーニングから、ダイニン軽中鎖をコードする遺伝子の突然変異を分離した。その表現型の解析から、ダイニンモーターが樹状突起を分岐させる活性を持つ分子複合体、あるいはオルガネラを輸送する仮説を立てた。積荷の候補を探索し、Rab5 を含む初期エンドソームが分岐形成に必要な積荷であることを示した。さらに、樹状突起と軸索のそれぞれにおける微小管極性を生体内で明らかにした。我々の結果は、ダイニン複合体が初期エンドソームの積み降ろしを調節することで、細胞体から突起末端に向かう分岐パターンが形作られる可能性を示している (Rolls et al., 2007; Satoh et al., 2008)。また、がん抑制遺伝子 DLC1(deleted in liver cancer 1)のショウジョウバエホモログが、生体内においてRho1の活性を負に調節することにより樹状突起ガイダンスを制御していることを示した (Sato et al., 2010)。
樹状突起の形成とその維持に、ミトコンドリアの機能が重要な役割を果たす結果も得た。Preli (protein of relevant evolutionary and lymphoid interest) は進化的に高度に保存されたミトコンドリアタンパク質であるが、その機能はほとんどわかっていない。ショウジョウバエの培養細胞を用い、preli 遺伝子の発現を抑制すると、ミトコンドリアが断片化し、クリステ構造が崩壊した。この時、チトクロームcオキシダーゼ活性や、ミトコンドリアの膜電位、細胞内のATP量が低下していた。preli 機能喪失神経細胞では、樹状突起パターンは著しく単純化した。また、野生型神経細胞と比べて樹状突起や軸索に分布するミトコンドリアが大幅に減少し、細胞体内では断片化したミトコンドリアが観察された。さらに、幼虫期のpreli 機能喪失細胞では樹状突起の太い枝がその付け根付近で切断され、成虫期では加齢と共に樹状突起の縮退が観察された。これらの表現型は、ショウジョウバエBclファミリーに属するanti-apoptotic分子であるBuffyの発現によって回復した。以上の結果から、Preli タンパク質はミトコンドリアの機能維持に積極的に働きかけ、正常な樹状突起形成および突起の縮退・変性を抑制することが明らかにされた (Tsubouchi et al., 2009)。
(4) ほ乳類神経細胞の樹状突起形成機構への発展
以前我々は、7回膜貫通型カドヘリンファミリーを発見し、da neuronとほ乳類ニューロンのいずれにおいても、7回膜貫通型カドヘリンが樹状突起の伸長を制御することを示していた (Shima et al., Developmental Cell 2004)。しかし、分子レベルでの作用機序は明らかではなかった。今回、二つのほ乳類7回膜貫通型カドヘリン (Celsr2とCelsr3) が、ホモフィリックな結合により異なる様式で活性化され、3量体Gタンパク質との共役を介して突起伸長を調節する仮説を支持する結果を得た (Shima et al., 2007)。また、ショウジョウバエ7回膜貫通型カドヘリンFlamingo (Fmi) の構造―機能解析により、未同定のリガンドとヘテロフィリックに結合して突起伸長を負に調節する局面があることが示唆された (Kimura et al., 2006)。
(5) 空間充填型突起パターンを形成する自己組織化モデル
クラス IV ニューロンや脊椎動物の網膜の神経節細胞などは、受容野全面をほぼ一様に覆い、かつ同種細胞間で重複の少ない空間充填型樹状突起を形成する。我々の以前の実験結果は、空間充填型樹状突起の発生が自己組織化機構により調節されていることを支持していた (Sugimura et al., Journal of Neuroscience, 2003)。今回、実験結果を再現できる二変数(ActivatorとSuppressor)反応拡散モデルを構築した。細胞内のActivatorは樹状突起の成長を制御する。SuppressorはActivatorから合成され、細胞外空間を拡散して突起間の抑制性の相互作用を担う。シミュレーションの結果、我々のモデルは突起の伸長と分岐をコントロールして、空間充填型樹状パターンを自律的に形成した。さらに、シミュレーションで得られたパターンを“突起整列度”という統計量で分類できること、そしてこの統計量は細胞内部のActivatorの分布を反映していることを発見した (Sugimura et al., 2007)。従って、この統計量から現実のニューロンの形態を分類し、さらに、その突起パターンから突起内のActivatorの分布を予測しうる。
また、我々はさらにモデルの改変を試み、これまでの知見から提唱された樹状突起間反発作用についての仮説を検証した。その結果、これまで批判を受けてきた「拡散性抑制因子仮説」に基づいた数理モデルが、野生型に見られる正常な樹状突起パターンと変異体に見られる異常な樹状突起パターンの両方を定性的に再現できることを明らかにした (Shimono et al., 2010)。この結果は、成体においても樹状突起パターン形成が拡散性の抑制因子によって制御されている可能性があることを示している。
(6) 樹状突起のリモデリングと個体の一生を通した維持機構の解明に向けて
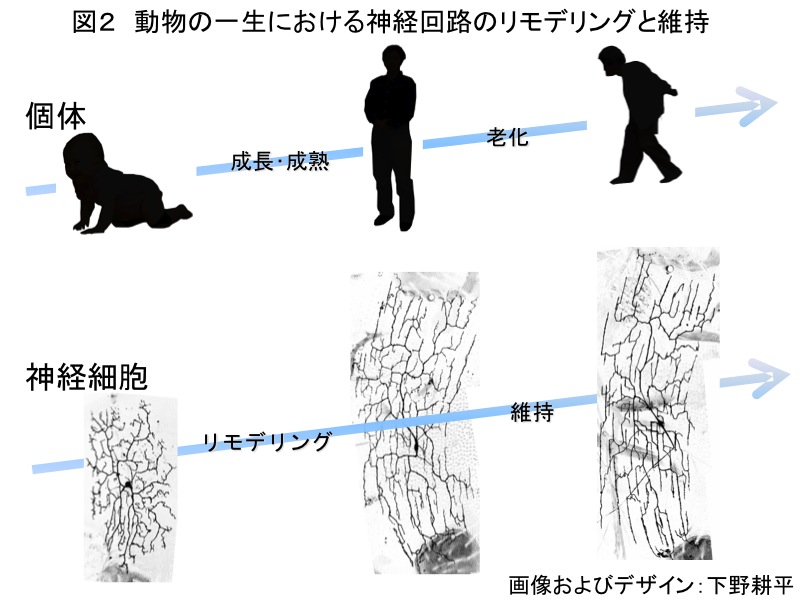
初期発生においていったん作られた神経回路は動物の様々な行動を支えるために作り変えられる。この神経回路の再編成の一つの様式として、樹状突起あるいは軸索のパターンを作り変える方法がある(図2)。一部のda neuronは、蛹期(変態期)において幼虫型から成虫型へと樹状突起パターンを作り変えることが知られていたため、樹状突起のリモデリングを研究する優れたモデル系となることが予想された。しかし、幼虫期のda neuronの中でどのneuronが成虫期まで生き残るのか、そして生き残ったneuronは新たにどのような形態の樹状突起を展開するのかといった基本的な情報がほとんど欠落していた。
そこで我々は、まず成虫期のda neuronを解剖学的に同定し、成虫の腹部には半体節あたり6つのda neuronが存在し、そのうち5つは幼虫期のda neuronの生き残りであることを明らかにした。また、その中の一つの da neuron は蛹期を生きのびて、羽化後数日の間に放射状から格子状へとその樹状突起パターンを作り変えた後、その形態を個体の一生を通して維持することを明らかにした (図2;Shimono et al., 2009)。以上の観察結果は、成虫期da neuronは樹状突起のリモデリングだけでなく、加齢に伴う神経突起の変性を一細胞レベルで感度よく検出できる系としても有用ではないかと考えた。実際、ミトコンドリア機能を低下させると、加齢に伴う樹状突起の変性を検出できた (Tsubouchi et al., 2009)。我々は大規模な突然変異スクリーニングを実現するために、ショウジョウバエで発達したモザイク法を改良し、da neuronにおいて簡便にかつ効率よく遺伝子の機能をノックアウトする系統を作製した。
(7)体の大きさに合わせて神経細胞の大きさを制御するしくみ(スケーリング)
体の大きさは人それぞれ異なっており、体が大きい人ほど脳や心臓といった臓器も大きいことが知られている。臓器を体の大きさに合わせたサイズに調節する様式(スケーリング)の一つとして、体の大小に応じてそれぞれの細胞のサイズを調節する方法があるが、神経細胞のような複雑な枝分かれの形態を示す細胞のサイズがどのように制御されているかについては、これまでほとんど分かっていなかった。
成虫の da neuron をモデル系として用いて、体の大きさを変化させた時に神経細胞の「サイズ」と「形(枝分かれのパターン)」 がどのような影響を受けるかを調べた。その結果、飢餓条件にして体が通常より小さくなったショウジョウバエでは、神経細胞は形を保ったまま小さくなっていること、つまり通常の神経細胞のミニチュア型(精巧な縮小コピー)となっていることを発見した。さらに、この「形を保ったままで の神経細胞のサイズの制御」に重要な遺伝子を見つけるために、遺伝学と次世代シーケンサを用いた解析を行い、ヒトのゲノムにも保存されているCHORD遺伝子を発見した。神経細胞が CHORD遺伝子の機能を失うと、適正な栄養条件下で体全体は十分に成長しているにも関わらず、神経細胞の突起はミニチュア型になってしまう。遺伝学的な解析の結果、CHORDタンパク質は Tor complex 2(TORC2)を介して栄養条件あるいは体の大きさを感知し、神経細胞のサイズを制御していることを見出した (Shimono et al., 2014)。
5.主な発表論文
(研究代表者、研究分担者及び連携研究者には下線)
- Shimono, K., Fujishima, K., Nomura, T., Ohashi, M., Usui, T., Kengaku, M., Toyoda, A., Uemura, T.
An evolutionarily conserved protein CHORD regulates scaling of dendritic arbors with body size. Scientific reports 4, 4415 (2014). - Hattori, Y., Usui, T., Satoh, D., Moriyama, S., Shimono, K., Itoh, T., Shirahige, K.,Uemura, T.
Sensory-neuron subtype-specific transcriptional programs controlling dendrite morphogenesis: genome-wide analysis of Abrupt and Knot/Collier. Developmental cell 27, 530-544 (2013). - Matsubara, D.*, Horiuchi, S., Shimono, K., Usui, T.*#, & Uemura, T. (*: Equal contribution; #: corresponding author).
The Seven-pass transmembrane Cadherin Flamingo Controls Dendritic Self-avoidance via its Binding to a LIM Domain Protein Espinas in Drosophila Sensory Neurons. Genes & Development, 25: 1982-1996 (2011). -
Sato, D., Sugimura, K., Satoh, D., & Uemura, T.
Crossveinless-c, the Drosophila homolog of tumor suppressor DLC1, regulates directional elongation of dendritic branches via down-regulating Rho1 activity. Genes to Cells, 15: 485-500 (2010). -
Shimono, K., Sugimura K., Kengaku, M., Uemura, T., & Mochizuki, A.
Computational Modeling of Dendritic Tiling By Diffusible Extracellular Suppressor. Genes to Cells, 15(2):137-49. Epub (2010) . -
Tsubouchi, A., Tsuyama, T., Fujioka, M., Kohda, H., Okamoto-Furuta, K., Aigaki, T., & Uemura, T.
Mitochondrial Protein Preli-like Is Required for Development of Dendritic Arbors and Prevents Their Regression in the Drosophila Sensory Nervous System. Development, Nov;136(22):3757-66(2009). -
Shimono, K., Fujimoto, A., Tsuyama, T., Yamamoto-Kochi, M., Sato, M., Hattori, Y., Sugimura, K., Usui, T., Kimura, K., & Uemura, T.
Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural Development, Oct 2;4:37(2009). -
Satoh, D., Sato, D., Tsuyama, T., Saito, M., Ohkura, H., M. Rolls, M., Ishikawa, F., & Uemura, T.
Spatial Control of Branching within Dendritic Arbors by Dynein-Dependent Transport of Rab5-Endosomes. Nature Cell Biology, 10(10)1164-71(2008). -
Sugimura, K., Shimono, K., Uemura, T., & Mochizuki, A.
Self-organizing Mechanism for Development of Space-filling Neuronal Dendrites. PLoS Computational Biology , 3: e212 (2007). -
Shima, Y., Kawaguchi, S., Kosaka, K., Nakayama, M., Hoshino, M., Nabeshima, Y., Hirano, T., & Uemura, T.
Opposing roles in neurite growth control by two 7-pass transmembrane cadherins. Nature Neuroscience , 10: 963-969 (2007). -
Hattori, Y., Sugimura, K., & Uemura, T.
Selective expression of Knot/Collier, a Transcriptional Regulator of the EBF/Olf-1 Family, Endows the Drosophila Sensory System with Neuronal Class-specific Elaborated Dendritic Patterns. Genes to Cells , 12: 1011-1022 (2007).[The cover of the issue] -
M Rolls, M., Satoh, D., J Clyne, P., L Henner, L., Uemura, T., & Q Doe, Q.
Polarity and intracellular compartmentalization of Drosophila neurons. Neural Development ,2:7-21 (2007). -
Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., & Uemura, T.
Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Current Biology 16:1678-83 (2006).
